3月8日~10日の間、神戸で第88回日本循環器学会総会が行われました。
そのタイミングの合わせて日本循環器学会の不整脈ガイドラインも改訂されました。
いくつかの大きな改訂点があるのですが今回はそのうちの一つ心房細動における脳梗塞予測スコアについてご説明いたします。
梗塞発症リスクを判断するための簡便なリスクスコアとして,CHADS2スコア,CHA2DS2-VASc スコアが従来用いられてきました.
しかし,海外で開発されたこれらのリスクスコアを本邦に適用できるか否かについて,日本人を対象とした3つのレジストリ
で統合解析を行ったところ,両スコアの構成要素のなかで脳梗塞発症に寄与する独立危険因子として同定されたのは
・年齢75歳以上
・高血圧
・脳卒中既往
の3因子のみでした。
さらに,2つの追加レジストリを加えた統合解析で得られた独立危険因子は,
・年齢75~84歳
・年齢85 歳以上
・高血圧,
・脳卒中既往
・BMI 18.5 kg/m2未満
・持続性/永続性心房細動
の6因子でした.
すなわち,CHADS2スコア,CHA2 DS2-VASc スコアと共通する危険因子として年齢,高血圧,脳卒中既往の3因子が追認された一方で
糖尿病,心不全,血管疾患は独立危険因子として同定されませんでした.
かわりに,85歳以上,BMI 18.5 kg/m2 未満,持続性/永続性心房細動という新たな危険因子が同定され重みづけを行い,
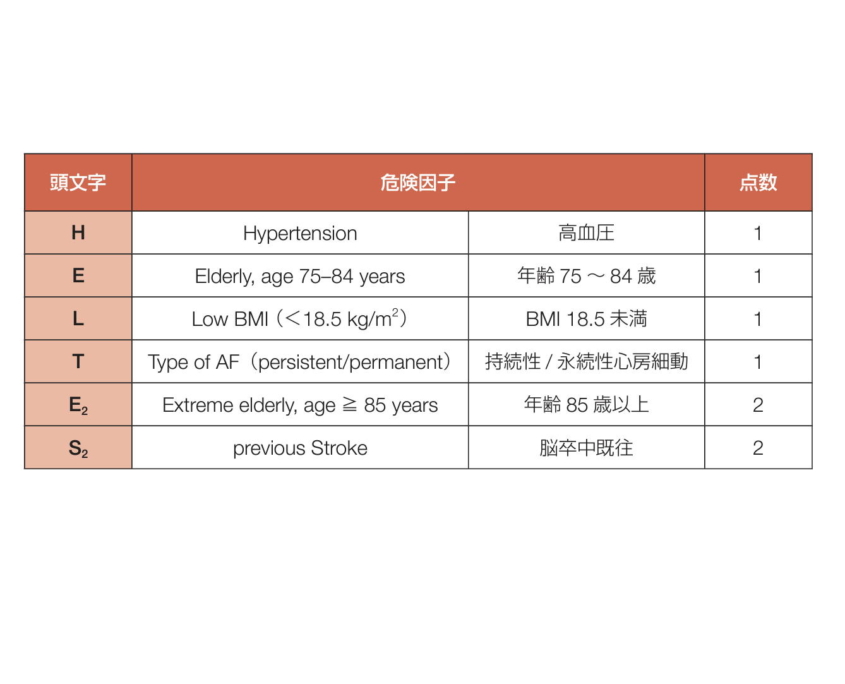
・高血圧(H: Hypertension)
・年 齢 75~84 歳(E: Elderly)
・BMI 18.5 kg/m2 未満(L: Low BMI)
・持続性/永続性心房細動(T: Type of AF)を 1点
・年齢 85歳以上(E: Extreme elderly)
・脳 卒 中 既 往 ( S: previous Stroke)を 2点
とする合計7点(年齢の Eが2つあるが配点は互いに背反)のリスクスコア評価法を定め,HELTE2S2 スコアと名付けられました。
HELT-E2S2スコア別の脳梗塞発症率は,
抗凝固療法なしの場合,0点で0.57%/年,1点で0.73%/年,2点で1.37%/年,3点で2.59%/年,4 点で3.96%/年,5点以上で5.82%/年とはっきりと点数依存性に上昇し、
HELT-E2S2スコア2点以上における脳梗塞発症率は,抗凝固療法ありの場合はなしの場合に比べて半分程度でした。
今後は日本ではHELTE2S2 スコアが脳梗塞治療の基準としてスタンダードになるでしょうね。